Benvenuto in STELFONTA®
STELFONTA®: Il trattamento innovativo ed efficace per i mastocitomi nei cani
Complete
responseFerita che guarisce per
seconda intenzione*Rapido ritorno alla
miglior qualità di vita
* Intervento minimo. Il sito di applicazione deve essere coperto per il primo giorno dopo il trattamento per evitare il contatto diretto con residui o fuoriuscite di prodotto.
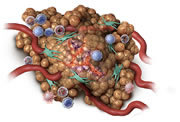
STELFONTA® rimuove il 75% dei mastocitomi canini con un singolo trattamento.*
L'87,2% dei cani ha avuto una risposta completa* dopo uno o due trattamenti**
COMPLETA
* Per risposta completa si intende la rimozione completa del tumore.Eisenhauer EA, et al. European Journal of Cancer 2009;45(2):228–47.
** Risultati di uno studio pilota sull'efficacia di campo: 68 su 78 cani hanno ottenuto una risposta completa a 28 giorni dopo uno o due trattamenti con STELFONTA®.
L'88% dei cani rimane sano* dopo12 mesiCampbell, Johannes, Reddell. Durability of clinical response to intratumoural tigilanol tiglate in canine MCT. Veterinary Cancer Society Conference 2019, Houston, Texas, USA.
TUMORE ASSENTE
*Nel sito di trattamento con STELFONTA®.
Studio Clinico: Studio clinico: Uno studio clinico multicentrico, randomizzato, controllato, condotto da veterinari e proprietari su 123 cani di proprietà con mastocitomi di volume ≤10cm3. L'efficacia è stata valutata utilizzando i criteri di valutazione della risposta nei tumori solidi (RECIST), dove per risposta completa si intende la rimozione completa del tumore.Eisenhauer EA, et al. European Journal of Cancer 2009;45(2):228–47. I cani del gruppo STELFONTA® sono stati trattati una volta all'inizio dello studio, oltre a ricevere i farmaci concomitanti. I pazienti del gruppo trattato con STELFONTA® o del gruppo di controllo che non hanno ottenuto una risposta completa al ventottesimo giorno potevano ricevere un secondo trattamento o un primo trattamento se il paziente era nel gruppo di controllo originale. Tutti i pazienti sia nel gruppo trattato con STELFONTA® che nel gruppo di controllo hanno ricevuto farmaci concomitanti. I pazienti che hanno ottenuto una risposta completa al 28° giorno in entrambe le fasi sono stati seguiti per 12 settimane dopo il trattamento finale. Dove possibile, i pazienti sono stati valutati a 12 mesi per la recidiva del tumore.
Guarda come STELFONTA® inizia ad agire entro poche ore,Melo SR, et al. Veterinary Cancer Society, Houston, Texas, USA. e come i tumori vengono generalmente distrutti dal 7° giorno.
-
![]()
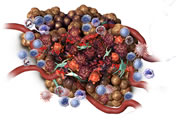
Giorno 1 Risposta infiammatoria acuta con gonfiore ed eritema che si estende fino ai margini del tumore e ai tessuti circostantiMelo SR, et al. Veterinary Cancer Society, Houston, Texas, USA.
-
![]()
Giorno 7 Si osserva la distruzione necrotica - nei cani si manifesta con annerimento, restringimento e perdita di secrezioni dense nella sede del tumore
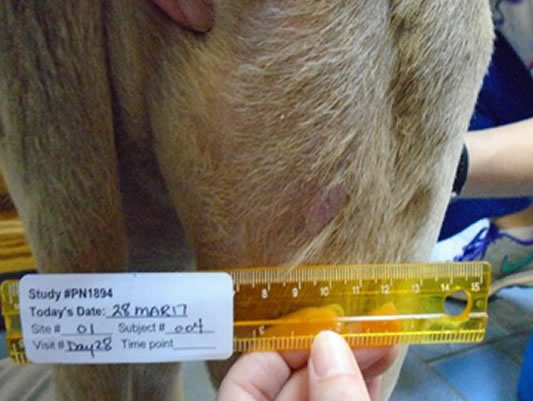
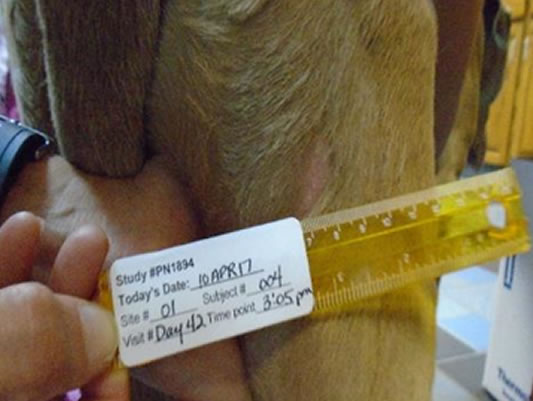
Guarigione spontanea*con oltre la metà dei tumori completamente guariti entro il 28° giorno
-
![]()
Giorno 28 56,5% ferite completamente guarite
-
![]()
Giorno 42 76,5% ferite completamente guarite
-
![]()
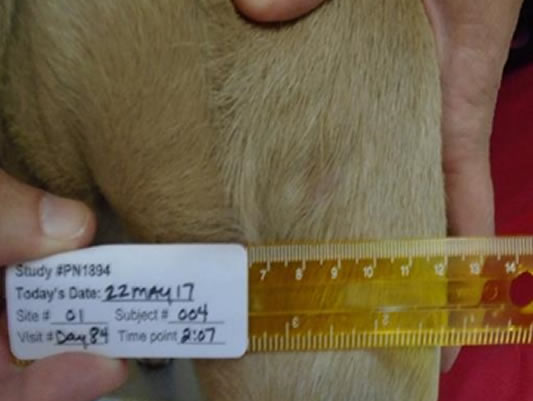
Giorno 84 96,5% ferite completamente guarite
Intervento minimo dopo il trattamento:
- Antibiotici a scopo profilattico non necessari
- Collare Elisabettiano non indispensabile
* Intervento minimo. Il sito di applicazione deve essere coperto per il primo giorno dopo il trattamento per evitare il contatto diretto con residui o fuoriuscite di prodotto.
I proprietari dei cani affermano che il trattamento con STELFONTA® non ha un impatto negativo sulla qualità della vitaMiller J, et al JVIM 2020; article accepted in press.
".... Seguendo alla lettera il trattamento, Daisy se l'è cavata eccezionalmente bene e ora sono passati 18 mesi senza recidive, e la sua qualità di vita è eccellente. Daisy ora ha 10 anni e si sta godendo gli ultimi anni con la grinta, l'energia e l'appetito tipici di un Jack Russell".
Brigitte e Brian Wright
Proprietari di Daisy

La storia di STELFONTA®: Alla scoperta delle difese naturali presenti in natura
![]() LA SCOPERTA
LA SCOPERTA
STELFONTA® è stato prodotto dalla società australiana QBiotics, che ha scoperto un nuovo composto biologicamente attivo (tigilanol tiglato) nei semi della pianta autoctona australiana Blushwood (Fontainea picrosperma).
Indicazioni approvate dall'EMA (Agenzia Europea per i Medicinali)
STELFONTA® è un trattamento con prescrizione medica approvato dall'EMA (Agenzia europea per i medicinali) indicato per:
- Mastocitomi non metastatici di tutti i gradi
- Mastocitomi non-resecabili
- Tutti i mastocitomi cutanei
- Mastocitomi sottocutanei dei cani localizzati al gomito o al garretto o distalmente ad essi
I tumori devono avere un volume inferiore o uguale a 8 cm3 e devono essere accessibili tramite iniezione intratumorale.
Importanti informazioni sulla sicurezza
La formazione delle ferite è una reazione prevista durante il trattamento con STELFONTA®.
La maggior parte degli eventi avversi più comuni, quali dolore, ecchimosi/eritema/edema nel sito di iniezione, zoppia nell'arto trattato e formazione di ferite, sono correlati al meccanismo d’azione di STELFONTA nella sede del tumore.
Per ulteriori informazioni, consultare il Riepilogo delle Caratteristiche del prodotto.